動物用医薬品の開発/製造販売承認申請に関する実践的ポイントSERVICE&PRODUCTS
7) 承認申請書提出後の、ヒアリング・調査会・指摘への対応のポイント
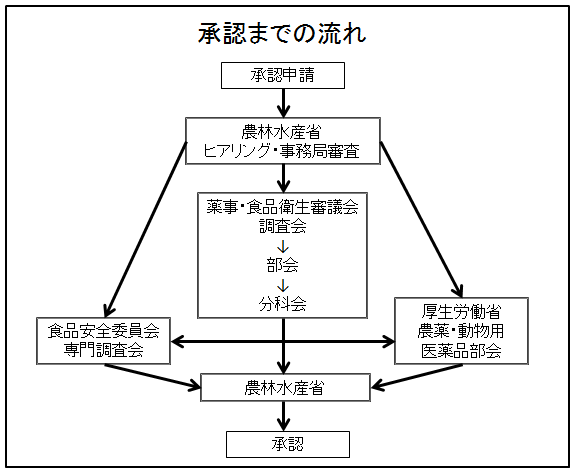
- 動物用医薬品の承認申請から承認までの流れは、新薬と後発品とでは大きく異なる。
○新薬の場合
①申請→②承認審査調整委員会(申請区分の確認等)→③ヒアリング→④事務局審査・指摘(原則として2回)→⑤調査会・部会等審議→⑥パブリックコメントの実施、食品安全委員会・厚生労働省へ諮問・答申→⑦省令改正等→⑧承認
○後発品の場合
①申請→②事務局審査・指摘(原則として2回)→③承認
③のヒアリングを受ける際のポイント
ヒアリングは、動物医薬品検査所で開催される(水産用医薬品を除く)。
最近では、一般薬および抗菌性物質製剤について、事前に「ヒアリング論点ペーパー」が送付される。ヒアリングで質問される論点であるので、その点について十分に準備して、ヒアリングに臨むことが重要である。
また、原則として「概要」の説明は不要である(一般薬および抗菌性物質製剤)。
※過去においては、ヒアリングに先立ち、申請者に10分間程度で製品の「概要」の説明が求められていた。
④事務局審査・指摘
指摘事項は、ヒアリング後2週間程度で送付される。
指摘事項が200~300項目もあげられる、不名誉な事例を聞くことがあるが、多くは承認申請書を作成する際に、注意して作成すれば、防げることも非常に多い。
また、誤字・脱字が多い文章は、それだけで承認申請の内容に不備があるイメージを、読み手である事務局に与えてしまう。
承認申請書の作成を、担当者1名に任せて、同じチーム内で内容のチェックを行わずに、申請する所・社もあるが、「誤字・脱字がある申請書は、会社としての恥」であると認識すべきである。
末尾に「承認申請書作成上の注意事項」を掲載したので、参考にしていただきたい。
【指摘に対する回答について】
○指摘に対して、「既承認製剤と同様である」や「現在申請中の○○○○と同様である」との回答は避け、具体的に記載すること。当該申請内容をもって判断する必要があるため、当該申請書および添付資料で判断できるものとすること。
○ヒアリング指摘事項の回答は、調査会の資料の一部となるので、十分に留意の上で作成すること。
○指摘により変更した事項については、申請書、概要書および添付資料に確実に反映させること。添付資料と概要書との整合性についても、確認すること。また、変更部分が確認できるよう、アンダーライン等を付すこと。
○指摘内容が理解できない場合は、速やかに事務局に確認し、的確に回答すること。指摘に対する回答は、科学的な根拠に基づいて回答すること。

⑤ 薬事・食品衛生審議会(各調査会・部会等)での審査
・調査会での審議は、事務局による事前審査が終了した品目から順次実施。
・スケジュール(目安:連休がある場合等には繰り上げ)
6週間前・・・新規品目の回答締切
5週間前・・・継続品目の回答締切
4週間前・・・上程の可否を決定(審査調整課担当から申請者に連絡)
3週間前・・・配付資料の整備状況の確認
2週間前の前日・・・配付資料提出期限
・調査会では、審議冒頭に、「概要」を用いて10分以内(最長でも15分)で製品と申請内容について説明する。
| アームズ・ワンポイントアドバイス |
- 農林水産省動物医薬品検査所(動薬検)からの指摘事項には、時機を遅らせることなく、できるだけ早くそして、準備できる限りのレベルの情報により、回答書を作成して提出することが重要です。
動薬検の担当官の先生方は、「基本的には、すべての申請を承認できるように導こう」という気持ちで審査して下さっています。そして、「承認審査のためには、この事項について明確にして下さいね」という思いで、質問がなされています。時機が遅れれば、他の案件がどんどん生じますし、調査会や部会など、定期的に開催されるスケジュールにどんどん間に合わなくなってしまいます。
AHRMS's POINT:回答書案は、時機を遅らせずに提出しましょう。
- 過去に一般薬のヒアリング指摘事項を、1年間、眠らせていたクライアントがおられました。ご担当者がワクチンの開発経験しかなく、一般薬はどのように回答すべきか分からないとのことだったのですが、弊社と共同で回答方針を立てて準備後、2ヵ月で回答することができ、その後の審査もスムースに進み、承認となりました。今では、その領域でトップシェアの動物用医薬品に成長しています。
この質問に対して、どのように回答すれば良いのだろうか? 動薬検の担当官の先生にお伺いになってもポイントが分からなければ、弊社にお問い合わせ下さい(フォームメール)。
秘密保持契約を締結した上で、有料ですが、経験豊かな担当者が誠意を持って、チェック致します。
|


